Gefälschte Studien zu Generika: Verstoß gegen Qualitätsstandards
Die Zulassung vieler Nachahmer-Medikamente in Europa basiert auf Studien der indischen Firma GVK Biosciences. Auf gefälschten Studien, wie es scheint.

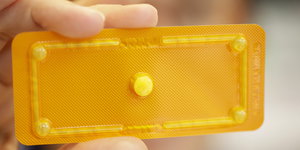
Was ist drin? Die Zulassung hunderter Produkte auf dem deutschen Markt steht in Frage. Bild: dpa
BERLIN taz | Die arzneimittelrechtlichen Zulassungen von mehr als hundert Medikamenten auf dem deutschen und europäischen Markt basieren möglicherweise auf gefälschten Studien an Menschen.
Das gab das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) am Freitag in Bonn bekannt – und zog unmittelbare Konsequenzen: Sämtliche betroffene Arzneimittel, deren Zulassungsgrundlage Studien der indischen Firma GVK Biosciences seien, dürften „so lange nicht mehr in Verkehr gebracht werden, bis der Zulassungsinhaber neue Studien mit Nachweis der Bioäquivalenz vorgelegt“.
Von einer „Gefahr für die Gesundheit der Patienten“ sei nach derzeitiger Erkenntnis „aber nicht auszugehen“, sagte ein BfArM-Sprecher der taz. Die rund 100 Pharmafirmen, die mit GVK Biosciences als Auftragsunternehmen zusammen gearbeitet hatten, seien aufgerufen worden, den Behörden sämtliche Studien vorzulegen. Unter den Herstellern sollen unter anderem die Firmen Betapharm aus Augsburg und Hexal aus Holzkirchen sein. Das hatte zuvor der Rechercheverbund von NDR, WDR und Süddeutscher Zeitung berichtet.
Um welche weiteren Hersteller und Arzneimittel es sich handelt, ließ das BfArM am Freitag offen. Gefälscht worden seien aber ausschließlich Studien für Nachahmer-Präparate, so genannte Generika. Für eine Genehmigung solcher Mittel müssen die Hersteller wie beim Original durch so genannte Bioäquivalenzstudien nachweisen, dass ihr Präparat genauso gut wirkt und verträglich ist wie das Originalpräparat.
Systematische Fälschung
Aufgeflogen waren die Fälschungen bereits während einer Überprüfung durch die französische Überwachungsbehörde ANSM im Mai: Damals hatten die französischen Prüfer das indische Unternehmen GVK Biosciences mit Sitz in Hyderabad genauer unter die Lupe genommen.
GVK Biosciences ist eines der größten Unternehmen für Auftragsforschungen in Asien („contract research organisation“), das im Auftrag von Pharmafirmen weltweit Studien durchführt und Daten erhebt. Von neun überprüften Studien aus dem Zeitraum „zwischen mindestens Juli 2008 und 2013“ war ein Teil der Ergebnisse offenbar „systematisch gefälscht“ worden. So heißt es in einem Brief der Leiterin der Abteilung für die Zulassung von Arzneimitteln bei der EU-Kommission, Sabine Jülicher, an den Ausschuss für Humanarzneimittel bei der Europäischen Arzneimittelzulassungsbehörde EMA, der der taz vorliegt.
Danach war in allen neun untersuchten Studien ein Teil der Elektrokardiogramme – also die Ergebnisse von Herzuntersuchungen – manipuliert worden. Einige der Untersuchungen waren demnach offenbar frei erfunden. Wenigstens „zehn verschiedene Personen“ hätten die Fälschungen in der Firma vorgenommen, heißt es in dem Schreiben weiter. Die Zahl der Mitwisser und der lange Zeitraum, in dem die Fälschungen stattgefunden hätten, würden „kritische Defizite“ im Qualitätssystem von GVK Biosciences aufzeigen, so Jülicher.
Einfluss auf Wirksamkeit
In Frage stehe nun die Zulässigkeit sämtlicher dort vorgenommener Bioäquivalenzstudien. Generika sind wirkstoffgleich mit den von ihnen nachgeahmten Originalpräparaten, aber nicht notwendigerweise gleich in der Art der Aufbereitung. Es kann zum Beispiel sein, dass die Tablette, die den Wirkstoff beinhaltet, aus anderen Substanzen besteht als das Original oder dass die Hülle anders ist.
Das kann zur Folge haben, dass der Wirkstoff beispielsweise früher oder später als beim Originalmedikament ins Blut gelangt – was wiederum Konsequenzen auf seine Wirksamkeit und Verträglichkeit haben kann. Die Bioäquivalenzstudien nun sollen zeigen, dass das Generikum tatsächlich identisch funktioniert wie das Original. Die Studien hierzu sind weitaus weniger aufwändig als klinische Prüfungen für Originalpräparate, häufig werden zur Prüfung der Generika nur 10 bis 20 Probanden eingeschlossen.
Zudem sind sie nur ein Teil am Ende einer Kette diverser Kontrollen, die das Generikum durchlaufen muss – und ohne die es keine Zulassung erhalten würde. Als Motivation für die Fälschungen vermutete ein Branchenkenner gegenüber der taz „Kosten-, Geld- und Zeitersparnis“.
Der Geschäftsführer von Pro Generika, dem Interessenverband der Generika- und Biosimilarunternehmen in Deutschland, Bork Bretthauer, warnte im Gespräch mit der taz davor, aufgrund der Vorkommnisse in Indien Nachahmerpräparate generell zu verteufeln: „Generika sind und bleiben das Rückgrat unserer Arzneimittelversorgung. Daher muss jetzt lückenlos und rasch aufgeklärt werden, wie es bei GVK Biosciences zu den groben Verstößen gegen die strengen Qualitätsstandards kommen konnte und was jetzt getan werden kann, damit sich so etwas nicht wiederholt.“
Internationale Zusammenarbeit nötig
Ähnlich äußerte sich der Sprecher des Verbands forschender Arzneimittelhersteller, Rolf Hömke, dessen Mitgliedsfirmen allerdings ausschließlich Originalpräparate herstellen und insofern von dem Fälschungsskandal nach derzeitigem Stand der Erkenntnisse gar nicht betroffen sind: „Es ist üblich, dass Hersteller, egal ob von Originalpräparaten oder Generika, auch mit ausländischen Firmen zusammen arbeiten, die darauf spezialisiert sind, klinische Studien zu organisieren“, sagte Hömke der taz.
Und solange dabei die internationalen wissenschaftlichen, rechtlichen wie medizinethischen Standards eingehalten würden, sei diese Form der Kooperation problemlos. Die Option, auf Studien in Schwellenländern wie Indien ganz zu verzichten, schloss Hömke aus: "Eine Sippenhaft nach Länderzugehörigkeit ist nicht angebracht".
Ab einer bestimmten Größe sei es zwingend notwendig, Arzneimittelstudien multinational durchzuführen, erklärte er: „Bei Herz-Kreislaufmedikamenten etwa, die eine hohe Probandenzahl erfordern, findet man sonst gar nicht genug Studienteilnehmer.“ Die Arzneimittelkommission der Deutschen Apotheker forderte am Freitag, als Konsequenz aus den Studienfälschungen „die Inspektionen vor Ort durch europäische und nationale Behörden zu verstärken“.



Leser*innenkommentare
John Doe
Es ist mehr als bedauerlich, dass nicht gesagt wird, um welche Produkte es handelt. Man kann davon ausgehen, dass Menschen, die auf Medikamente angewiesen sind und von den Krankenkassen zum Gebrauch von Generika gezwungen werden, wissen wollen, ob sie davon betroffen sind oder nicht.
1714 (Profil gelöscht)
Gast
@John Doe Wo kämen wir denn da hin? Das ist unverantwortlich, denn dadurch könnten die Gewinne der Firmen geschmälert werden! Ein paar gesundheitlich Geschädigte dagegen sind doch nicht das Problem! Die sind selbst schuld, sollen sie doch nicht krank werden...